ໃນຖານະເປັນໃຫມ່ໃນຫ້ອງທົດລອງ, ມັນບໍ່ແມ່ນວຽກທີ່ດີທີ່ຈະກວດສອບພືດໃນທາງບວກຈາກຊໍ່ພືດທີ່ມີອັດຕາການປ່ຽນແປງຕ່ໍາ.ກ່ອນອື່ນ ໝົດ, DNA ຕ້ອງໄດ້ຮັບການສະກັດຈາກຕົວຢ່າງຈໍານວນຫລາຍເທື່ອລະອັນ, ແລະຫຼັງຈາກນັ້ນ genes ຕ່າງປະເທດຈະຖືກກວດພົບໂດຍ PCR.ຢ່າງໃດກໍ່ຕາມ, ຜົນໄດ້ຮັບແມ່ນມັກຈະຫວ່າງເປົ່າແລະແຖບທີ່ມີບາງລາຍການບາງຄັ້ງ, ແຕ່ວ່າມັນເປັນໄປບໍ່ໄດ້ທີ່ຈະກໍານົດວ່າມີການກວດພົບທີ່ພາດໂອກາດຫຼືການກວດພົບທີ່ບໍ່ຖືກຕ້ອງ..ມັນເປັນການສິ້ນຫວັງຫຼາຍທີ່ຈະປະເຊີນກັບຂະບວນການທົດລອງແລະຜົນໄດ້ຮັບດັ່ງກ່າວ?ບໍ່ຕ້ອງເປັນຫ່ວງ, ອ້າຍສອນວິທີກວດຫາພືດທີ່ເປັນຜົນມາຈາກການປ່ຽນພັນພືດຢ່າງງ່າຍດາຍ ແລະ ຖືກຕ້ອງ.
ຂັ້ນຕອນທີ 1
ການອອກແບບ primers ການກວດສອບ
ກໍານົດ gene endogenous ແລະ exogenous gene ທີ່ຈະກວດພົບຕາມຕົວຢ່າງທີ່ຈະທົດສອບ, ແລະເລືອກຕົວແທນ 100-500bp ລໍາດັບໃນ gene ສໍາລັບການອອກແບບ primer.primers ທີ່ດີສາມາດຮັບປະກັນຄວາມຖືກຕ້ອງຂອງຜົນການກວດພົບແລະຫຼຸດຜ່ອນເວລາການກວດພົບ (ເບິ່ງເອກະສານຊ້ອນທ້າຍສໍາລັບ primers ກວດຫາທີ່ໃຊ້ທົ່ວໄປ).
ສັງເກດ: primers ອອກແບບໃຫມ່ຈໍາເປັນຕ້ອງໄດ້ເພີ່ມປະສິດທິພາບເງື່ອນໄຂການຕິກິຣິຍາແລະກວດສອບຄວາມຖືກຕ້ອງ, ຄວາມແມ່ນຍໍາແລະຂອບເຂດຈໍາກັດການກວດພົບກ່ອນທີ່ຈະກວດພົບຂະຫນາດໃຫຍ່.
ຂັ້ນຕອນທີ 2
ອອກແບບອະນຸສັນຍາການທົດລອງ
ການຄວບຄຸມທາງບວກ: ໃຊ້ DNA ທີ່ບໍລິສຸດທີ່ມີຊິ້ນສ່ວນເປົ້າຫມາຍເປັນແມ່ແບບເພື່ອກໍານົດວ່າລະບົບປະຕິກິລິຢາ PCR ແລະເງື່ອນໄຂແມ່ນປົກກະຕິ.
ການຄວບຄຸມທາງລົບ/ເປົ່າ: ໃຊ້ແມ່ແບບ DNA ຫຼື ddH2O ທີ່ບໍ່ມີຊິ້ນສ່ວນເປົ້າໝາຍເປັນແມ່ແບບເພື່ອກວດຫາວ່າມີແຫຼ່ງທີ່ມາຂອງການປົນເປື້ອນຢູ່ໃນລະບົບ PCR.
ການຄວບຄຸມການອ້າງອີງພາຍໃນ: ໃຊ້ການປະສົມ primer/probe ຂອງ gene endogenous ຂອງຕົວຢ່າງເພື່ອທົດສອບເພື່ອປະເມີນວ່າ PCR ສາມາດກວດພົບໄດ້ຫຼືບໍ່.
ແຈ້ງການ:
ການຄວບຄຸມທາງບວກ, ລົບ / ຫວ່າງເປົ່າແລະການຄວບຄຸມການຄວບຄຸມພາຍໃນຄວນໄດ້ຮັບການກໍານົດສໍາລັບແຕ່ລະການທົດສອບເພື່ອປະເມີນຄວາມຖືກຕ້ອງຂອງຜົນການທົດລອງ.
ການກະກຽມການທົດລອງ
ກ່ອນທີ່ຈະນໍາໃຊ້, ສັງເກດເບິ່ງວ່າການແກ້ໄຂແມ່ນປະສົມຢ່າງເທົ່າທຽມກັນ.ຖ້າພົບຝົນ, ມັນຈໍາເປັນຕ້ອງໄດ້ລະລາຍແລະປະສົມຕາມຄໍາແນະນໍາກ່ອນທີ່ຈະນໍາໃຊ້.2×PCR ປະສົມຕ້ອງໄດ້ຮັບການທໍ່ແລະປະສົມຊ້ໍາກັບ micropipette ກ່ອນທີ່ຈະນໍາໃຊ້ເພື່ອຫຼີກເວັ້ນການກະຈາຍ ion ທີ່ບໍ່ສະເຫມີພາບ.
ແຈ້ງການ:
ເອົາຄູ່ມືອອກແລະອ່ານມັນຢ່າງລະມັດລະວັງ, ແລະເຮັດການກຽມພ້ອມກ່ອນການທົດລອງຢ່າງເຂັ້ມງວດຕາມຄວາມຕ້ອງການຂອງຄູ່ມື.
ຂັ້ນຕອນທີ 4
ກະກຽມລະບົບປະຕິກິລິຍາ PCR
ອີງຕາມອະນຸສັນຍາການທົດລອງ, ປະສົມ primers, H2O, ແລະ 2 × PCR ປະສົມຢ່າງເທົ່າທຽມກັນ, centrifuge ແລະແຈກຢາຍໃຫ້ເຂົາເຈົ້າໃນແຕ່ລະທໍ່ຕິກິຣິຍາ.
ແຈ້ງການ:
ສໍາລັບການທົດສອບຂະຫນາດໃຫຍ່ຫຼືໄລຍະຍາວ, ແນະນໍາໃຫ້ໃຊ້ລະບົບປະຕິກິລິຢາ PCR ທີ່ມີ enzyme UNG, ເຊິ່ງປະສິດທິຜົນສາມາດຫຼີກເວັ້ນການປົນເປື້ອນຂອງ aerosol ທີ່ເກີດຈາກຜະລິດຕະພັນ PCR.
ຂັ້ນຕອນທີ 5
ເພີ່ມແມ່ແບບຕິກິຣິຍາ
ການນໍາໃຊ້ເທກໂນໂລຍີ Direct PCR, ບໍ່ຈໍາເປັນຕ້ອງມີຂະບວນການຊໍາລະລ້າງອາຊິດ nucleic ທີ່ຫນ້າເບື່ອ, ແມ່ແບບຕົວຢ່າງສາມາດກະກຽມພາຍໃນ 10 ນາທີ, ແລະລະບົບປະຕິກິລິຍາ PCR ທີ່ສອດຄ້ອງກັນສາມາດເພີ່ມໄດ້.
ແຈ້ງການ:
ວິທີການ cleavage ມີຜົນກະທົບການຊອກຄົ້ນຫາທີ່ດີກວ່າ, ແລະຜະລິດຕະພັນທີ່ໄດ້ຮັບສາມາດໄດ້ຮັບການນໍາໃຊ້ສໍາລັບຕິກິລິຍາການຊອກຄົ້ນຫາຫຼາຍ.
5.1: ການຂະຫຍາຍໃບໂດຍກົງ
ອີງຕາມຂະຫນາດຂອງຮູບໃນຄູ່ມື, ຕັດເນື້ອເຍື່ອໃບທີ່ມີເສັ້ນຜ່າກາງ 2-3mm ແລະວາງໄວ້ໃນລະບົບປະຕິກິລິຍາ PCR.
ຫມາຍເຫດ: ໃຫ້ແນ່ໃຈວ່າຊິ້ນສ່ວນຂອງໃບຖືກແຊ່ນ້ໍາຢ່າງສົມບູນໃນການແກ້ໄຂປະຕິກິລິຍາ PCR, ແລະຢ່າເພີ່ມເນື້ອເຍື່ອໃບຫຼາຍເກີນໄປ.
5.2: ວິທີການແບ່ງໃບ
ຕັດເນື້ອເຍື່ອໃບທີ່ມີເສັ້ນຜ່າກາງ 5-7 ມມແລະວາງໄວ້ໃນທໍ່ centrifuge.ຖ້າທ່ານເລືອກໃບທີ່ແກ່ແລ້ວ, ກະລຸນາຫຼີກເວັ້ນການໃຊ້ແພຈຸລັງຂອງເສັ້ນກ່າງຕົ້ນຕໍຂອງໃບ.Pipette 50ul Buffer P1 lysate ເຂົ້າໄປໃນທໍ່ centrifuge ເພື່ອຮັບປະກັນວ່າ lysate ສາມາດ immersed ເນື້ອເຍື່ອໃບຢ່າງສົມບູນ, ເອົາໃສ່ໃນ cycler ຄວາມຮ້ອນຫຼືອາບນ້ໍາໂລຫະ, ແລະ lyse ຢູ່ທີ່ 95 ° C ສໍາລັບ 5-10 ນາທີ.
ຕື່ມການແກ້ໄຂ 50ul Buffer P2 neutralization ແລະປົນກັນ.lysate ຜົນໄດ້ຮັບສາມາດຖືກນໍາໃຊ້ເປັນແມ່ແບບແລະເພີ່ມເຂົ້າໃນລະບົບປະຕິກິລິຍາ PCR.
ຫມາຍເຫດ: ປະລິມານຂອງແມ່ແບບແມ່ນຢູ່ລະຫວ່າງ 5-10% ຂອງລະບົບ PCR, ແລະບໍ່ຄວນເກີນ 20% (ຕົວຢ່າງເຊັ່ນໃນລະບົບ PCR 20μl, ເພີ່ມ 1-2μl ຂອງການແກ້ໄຂ lysis, ບໍ່ເກີນ 4μl).
ຂັ້ນຕອນທີ 6
ປະຕິກິລິຍາ PCR
ຫຼັງຈາກ centrifuging ທໍ່ປະຕິກິລິຍາ PCR, ມັນໄດ້ຖືກຈັດໃສ່ໃນເຄື່ອງມື PCR ສໍາລັບການຂະຫຍາຍ.
ແຈ້ງການ:
ປະຕິກິລິຍາໃຊ້ແມ່ແບບທີ່ບໍ່ບໍລິສຸດສໍາລັບການຂະຫຍາຍ, ດັ່ງນັ້ນຈໍານວນຂອງວົງຈອນການຂະຫຍາຍແມ່ນ 5-10 ຮອບຫຼາຍກ່ວາໃນເວລາທີ່ໃຊ້ແມ່ແບບ DNA ບໍລິສຸດ.
ຂັ້ນຕອນທີ 7
ການກວດຫາ electrophoresis ແລະການວິເຄາະຜົນໄດ້ຮັບ
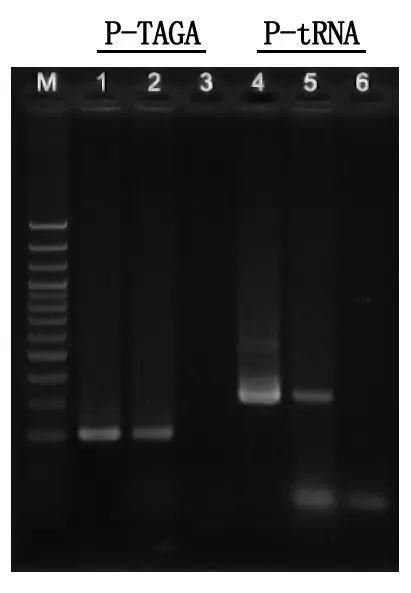
M: 100bp DNA Ladder
1\4: ວິທີ DNA ບໍລິສຸດ
2\5: ວິທີການ PCR ໂດຍກົງ
3\6: ການຄວບຄຸມເປົ່າ
QC:
ຜົນການທົດສອບຂອງການຄວບຄຸມຕ່າງໆທີ່ກໍານົດໄວ້ໃນການທົດລອງຄວນຕອບສະຫນອງເງື່ອນໄຂດັ່ງຕໍ່ໄປນີ້.ຖ້າບໍ່ດັ່ງນັ້ນ, ສາເຫດຂອງບັນຫາຄວນໄດ້ຮັບການວິເຄາະ, ແລະການທົດສອບຄວນໄດ້ຮັບການປະຕິບັດອີກເທື່ອຫນຶ່ງຫຼັງຈາກບັນຫາໄດ້ຖືກລົບລ້າງ.
ຕາຕະລາງ 1. ຜົນການທົດສອບປົກກະຕິຂອງກຸ່ມຄວບຄຸມຕ່າງໆ
* ເມື່ອ plasmid ຖືກນໍາໃຊ້ເປັນການຄວບຄຸມໃນທາງບວກ, ຜົນການທົດສອບ gene endogenous ສາມາດເປັນລົບ
ຜົນການຕັດສິນ:
A. ຜົນການທົດສອບຂອງ gene endogenous ຂອງຕົວຢ່າງແມ່ນເປັນລົບ, ຊີ້ໃຫ້ເຫັນວ່າ DNA ທີ່ເຫມາະສົມສໍາລັບການກວດ PCR ທໍາມະດາບໍ່ສາມາດສະກັດຈາກຕົວຢ່າງຫຼື DNA ສະກັດມີສານ inhibitors ປະຕິກິລິຍາ PCR, ແລະ DNA ຄວນໄດ້ຮັບການສະກັດອີກເທື່ອຫນຶ່ງ.
B. ຜົນການທົດສອບຂອງ gene endogenous ຂອງຕົວຢ່າງແມ່ນເປັນບວກ, ແລະຜົນການທົດສອບຂອງ gene exogenous ແມ່ນເປັນລົບ, ຊີ້ໃຫ້ເຫັນວ່າ DNA ທີ່ເຫມາະສົມສໍາລັບການກວດ PCR ທໍາມະດາແມ່ນສະກັດຈາກຕົວຢ່າງ, ແລະສາມາດຕັດສິນໄດ້ວ່າ XXX ບໍ່ໄດ້ກວດພົບຢູ່ໃນຕົວຢ່າງ.
C. ຜົນການທົດສອບຂອງ gene endogenous ຂອງຕົວຢ່າງແມ່ນເປັນບວກ, ແລະຜົນການທົດສອບຂອງ gene exogenous ເປັນບວກ, ຊີ້ໃຫ້ເຫັນວ່າ DNA ທີ່ເຫມາະສົມສໍາລັບການກວດ PCR ທໍາມະດາໄດ້ຖືກສະກັດອອກຈາກຕົວຢ່າງ, ແລະ DNA ຂອງຕົວຢ່າງມີ XXX gene.ການທົດລອງການຢືນຢັນສາມາດດໍາເນີນການຕື່ມອີກ.
ຂັ້ນຕອນທີ 8
ການອອກແບບ primers ການກວດສອບ
ຫຼັງຈາກການທົດລອງ, ໃຊ້ການແກ້ໄຂ sodium hypochlorite 2% ແລະການແກ້ໄຂ 70% ethanol ເພື່ອເຊັດພື້ນທີ່ທົດລອງເພື່ອປ້ອງກັນມົນລະພິດສິ່ງແວດລ້ອມ.
ເວລາປະກາດ: ກັນຍາ-08-2021